
仿制药研发流程:关键研发步骤与一半科技PLM系统的应用
近年来,国家对仿制药提出了新的要求,旨在提高仿制药质量,确保其与原研药的同等性,以满足临床需求和患者安全。
产品应用
近年来,国家对仿制药提出了新的要求,旨在提高仿制药质量,确保其与原研药的“同等性”,以满足临床需求和患者安全。本文将结合相关法规,对仿制药研发过程中需要注意的要点进行解析,并详细阐述仿制药研发的关键步骤。

一、仿制药研发新要求
仿制药研发目标是实现规模化生产,强调本地化,以达到“替代性”。其核心要求是与原研药“同”,即在安全性、有效性和质量等方面与原研药一致。
1. 安全性“同”
安全性方面,仿制药需控制有关物质,并根据剂型特点进行针对性控制:
口服固体制剂:主要控制有关物质,确保其含量符合标准。
液体制剂:除控制有关物质外,还需对防腐剂、氧化剂等对人体有影响的物质进行控制,并将其含量测定定入质量标准。
2. 有效性“同”
有效性方面,仿制药需通过生物等效性研究证明其与原研药具有相同的生物利用度,即在相同剂量下,药物在人体内的吸收、分布、代谢和排泄过程相同。
3. 质量“同”
质量方面,仿制药需符合相关质量标准,包括但不限于:
化学成分一致性:仿制药的化学成分与原研药一致。
物理性质一致性:仿制药的物理性质,如外观、溶解度、粒度等,与原研药一致。
稳定性一致性:仿制药的稳定性与原研药一致,能够在规定的储存条件下保持稳定。
二、仿制药研发关键步骤
仿制药研发是一个复杂的过程,需要经过一系列严格的步骤,才能确保其质量和安全。以下列举了仿制药研发的主要步骤:
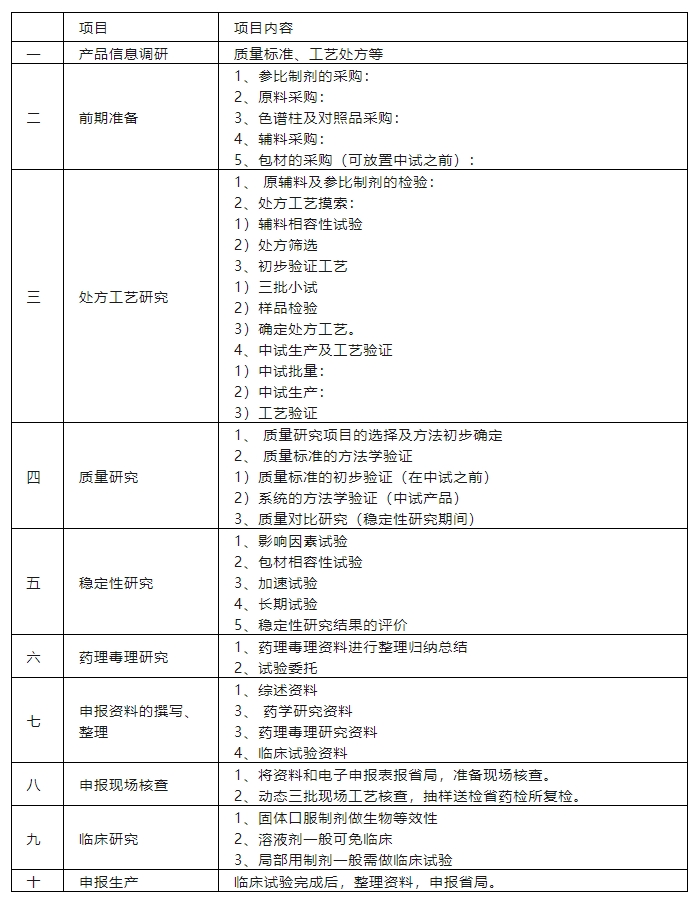
1. 原研药分析
首先需要对原研药进行全面的分析,包括化学成分分析、物理性质分析、稳定性分析等,以确定原研药的质量标准。
2. 仿制药工艺研究
根据原研药的分析结果,选择合适的工艺路线,并进行工艺优化,以确保仿制药的质量符合要求。
3. 中试生产
在中试阶段,需要进行小规模生产,以验证工艺的可行性和稳定性。
中试批量:口服固体制剂投料量为10公斤左右,液体制剂也为10公斤左右。
中试生产:用确定的工艺在GMP车间生产三批中试产品,填写生产批记录。
工艺验证:收集、评估整个工艺设计阶段及生产全过程的数据资料,确立工艺能持续一致地生产出符合质量要求的产品的有科学依据的证据。
4. 生物等效性研究
生物等效性研究是仿制药研发的重要环节,需要通过临床试验来证明仿制药与原研药具有相同的生物利用度。
5. 质量控制
在整个研发过程中,需要进行严格的质量控制,确保仿制药的质量符合要求。
6. 临床试验
在完成生物等效性研究后,还需要进行临床试验,以评估仿制药的安全性、有效性和药代动力学特征。
7. 注册申报
完成所有研发步骤后,需要向国家药品监督管理局提交注册申报资料,并通过审批后才能上市销售。
随着仿制药研发技术的不断进步,仿制药的质量和安全性将得到进一步提升。未来,仿制药研发将更加注重创新,例如开发新型仿制药,如生物仿制药,以满足临床需求和患者的个性化治疗需求。
PLM系统在仿制药研发中的应用
1.信息整合与管理
PLM系统能够集中管理研发过程中产生的所有数据和文档,包括实验记录、质量标准、法规要求等。这种集中化的信息管理使得研发团队能够快速访问所需信息,减少信息孤岛,提高决策效率。
2.流程标准化
PLM可以帮助建立标准化的研发流程,确保每个环节都遵循既定的操作规范。这种标准化不仅提高了研发效率,还降低了因流程不一致而导致的错误风险。
3.协作与沟通
PLM系统提供了一个协作平台,使得不同部门(如研发、质量控制、生产等)之间能够实时沟通与协作。通过共享信息和进度,团队成员能够更好地协调工作,及时解决问题。
4.合规性管理
在仿制药研发中,合规性是一个重要的考量。PLM系统能够帮助企业跟踪法规变化,确保研发过程符合最新的法律法规要求。同时,系统可以自动生成合规性报告,简化审计流程。
5.风险管理
PLM系统能够对研发过程中的潜在风险进行识别和评估。通过数据分析和模拟,研发团队可以提前识别可能的问题,并制定相应的应对策略,从而降低研发失败的风险。
6.版本控制与追溯
在仿制药研发中,产品配方和工艺的变更是常见的。PLM系统提供版本控制功能,确保所有变更都有据可查,并能够追溯到历史记录。这对于确保产品质量和合规性至关重要。
7.数据分析与决策支持
PLM系统集成的数据分析工具能够帮助研发团队从大量数据中提取有价值的信息,支持科学决策。通过数据驱动的决策,团队能够更快地调整研发策略,提高成功率。
PLM在仿制药研发流程中提供了全面的支持,帮助企业提高研发效率、确保产品质量和合规性。通过有效的信息管理、流程标准化和协作机制,PLM系统能够为仿制药的成功研发提供强有力的保障。随着市场竞争的加剧,采用PLM系统将成为仿制药企业提升竞争力的重要手段。


 产品生命周期
产品生命周期
 项目管理系统
项目管理系统
 电子实验记录本
电子实验记录本
 研发仓库系统
研发仓库系统
 仪器设备管理
仪器设备管理
 医药行业分类
医药行业分类


